关于我们
 BellBrook Labs成立于2002年,位于威斯康星州麦迪逊市.致力提供药物筛选所需的高通量微孔板试剂盒和微流体细胞分析芯片,是高通量分析靶蛋白(protein targets)和表型细胞(phenotypic cellular)的优秀工具,为世界各地的研究人员提供创新的线索发现和优化工具.
BellBrook Labs成立于2002年,位于威斯康星州麦迪逊市.致力提供药物筛选所需的高通量微孔板试剂盒和微流体细胞分析芯片,是高通量分析靶蛋白(protein targets)和表型细胞(phenotypic cellular)的优秀工具,为世界各地的研究人员提供创新的线索发现和优化工具.
位置: 首页 > 技术研究
新型冠状病毒2019-nCoV及SARS入侵宿主途径解析
发表时间:[2021-01-15 16:18:55]
2019-nCoV和SARS疫战中的特洛伊木马—ACE2
2019-nCoV袭来,扰乱了很多人的“原计划”,不禁让人回想起2003年的“SARS非典疫情”(Severe Acute Respiratory Syndrome,SARS),以及肆虐中东地区的中东呼吸综合症MERS(Middle East Respiratory Syndrome,MERS)。以上两种疫病的爆发均与冠状病毒有关。
那么冠状病毒到底是什么呢?
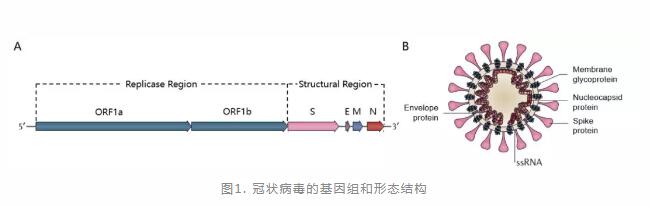
冠状病毒直径约60-220nm,病毒内包含正向的单链RNA,单链的RNA长度约27到32kb,分为两大组成部分:复制酶编码区和结构蛋白编码区。
复制酶编码区主要表达编码两个大基因,ORF1a和ORF1b,它们编码16个非结构蛋白(nsp1-nsp16),在整个冠状病毒中高度保守(图1A)。结构蛋白编码区主要编码冠状病毒四个结构蛋白:刺突糖蛋白(Spike Protein,S),是受体结合位点;包膜糖蛋白(Envelope Protein,E),帮助病毒进入宿主细胞;膜糖蛋白(Membrane glycoprotein,M),负责营养物质的跨膜运输、新生病毒的出芽释放;核衣壳蛋白(Nucleocapsid protein,N),保护RNA的稳定性[1](图1B) 。
冠状病毒是如何入侵宿主细胞的呢?
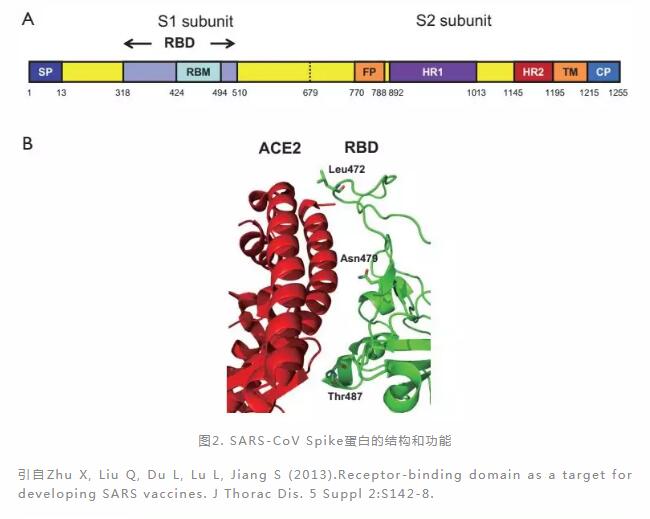
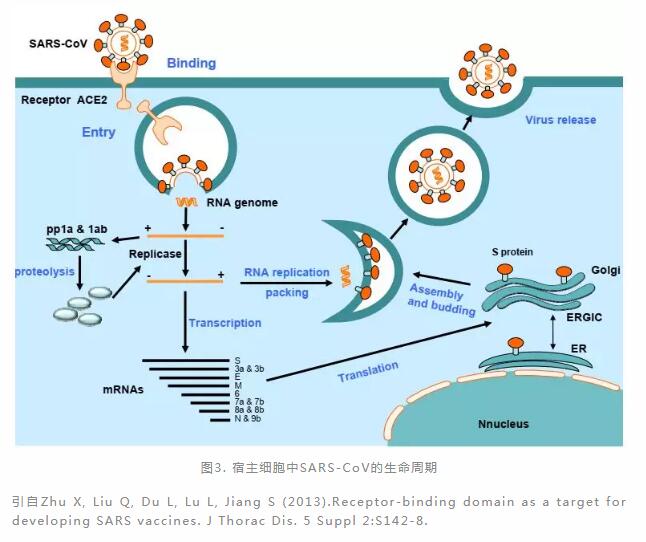
以SARS-CoV为例,SARS-CoV表面的Spike蛋白由与受体结合的S1亚基和介导膜融合的S2跨膜结构域组成,S1亚基中的受体结合区(Receptor Binding Domain, RBD) 结构域与粘膜细胞表面的受体血管紧张素转换酶2(Angiotensin-Converting Enzyme 2,ACE2)结合,促使SARS-CoV进入宿主细胞(图2),随后暴露病毒RNA,翻译出病毒RNA复制酶,形成RNA复制酶-转录酶复合物。这种复合物通过复制和转录来形成RNA负链,在转录过程中,通过不连续转录产生7-9个RNA的子集,包括编码所有结构蛋白的RNA,翻译成病毒的结构蛋白。细胞质中的RNA和结构蛋白组装成新的病毒颗粒,经胞吐作用从被感染的细胞中释放出来,以感染新的细胞,由此逐渐蔓延至支气管,肺部(图3)。在这个过程中,ACE2就像是特洛伊木马,帮助SARS-CoV进入人体。
Nature杂志2020年2月3日分别发表了武汉病毒所石正丽团队和复旦大学公共卫生学院张永振团队的最新研究结果:如今横行的2019-nCoV与SARS-CoV之间的核苷酸相似性达到89.1%[2],且与SARS-CoV使用相同的细胞受体ACE2进入细胞[3]。
ACE2在胃肠道,心脏,肾脏,肺,睾丸和大脑中表达,蛋白大小约120KD。ACE2能够作为肾素-血管紧张素系统(该系统能维持人体内环境的相对稳定,但是过表达会导致血压、水、电解质的失衡)的负调节剂以保护心血管系统,也能在肾脏和肠道的氨基酸吸收中发挥功能,还对减少中风起积极作用[4, 5]。2003年,SARS-CoV肆虐中国以后,科学家们很快解析到ACE2是SARS-CoV进入细胞的受体[6],随后关于ACE2和SARS-CoV相互作用的研究从未停止过。
中国医学科学院基础医学研究所医学分子生物学国家重点实验室的蒋澄宇教授团队对小鼠进行PAMAM纳米颗粒诱导肺损伤实验中发现,Ace2基因敲除的小鼠,肺损伤加剧,这表明Ace2在肺功能中发挥重要作用[7]。
Iowa大学的Stanley Perlman团队,构建了由人类细胞角蛋白18(Cytokeratin 18,K18)启动子调控的人源基因ACE2表达的转基因小鼠,K18-hACE2感染SARS-CoV4天后的肺泡中检测到病毒抗原,而野生型小鼠感染病毒后肺泡中并未检测到病毒抗原[8, 9]。
2016年North Carolina大学的Ralph S. Baric教授团队发表在PNAS上的一篇文章也证明了小鼠体内过表达人源ACE2表现出对SARS-CoV和WIV1-CoV(以SARS-CoV为模板构造的传染性相对较弱的CoV,受体依然为ACE2,但是实验小鼠的死亡率降低,能获得更多临床前数据)的易感,该团队创制了由肺纤毛上皮细胞启动子HFH4启动人源ACE2基因的转基因小鼠,HFH4-hACE2小鼠中ACE2并没有表现出预期的肺部特异表达,在脑,肝,肾和胃肠道中也检测到不同程度的表达。所有感染SARS-CoV的HFH4-ACE2小鼠的体重减轻了20%以上,并在肺和脑中检测到SARS-CoV强大的复制能力,而在感染WIV1-CoV7天后体重减轻> 10%的小鼠在大脑中检测到大量的病毒复制,但在肺中的复制明显降低,体重减轻<10%小鼠的肺和脑中的病毒复制较低,且产生了足够的适应性免疫应答以清除病毒并在感染后存活。该团队还找到一种单克隆抗体227.14,能够保护HFH4-ACE2小鼠免受致命的SARS-CoV 和WIV-CoV攻击,经抗体治疗后,HFH4-ACE2小鼠肺中均未检测到病毒[10](图4)。
如何驾驭这个特洛伊木马、什么样的ACE2动物模型更适合做临床前研究还需要进一步探讨。希望ACE2能够成为治疗SARS和2019-nCoV病毒的突破口,早日找到有效的治疗方法,造福人类。

